Le virus d’Usutu, un flavivirus transmis par les moustiques du genre Culex, est l’objet d’une attention croissante en Europe. Initialement identifié en Afrique, il est aujourd’hui bien implanté dans plusieurs pays européens. Chez les oiseaux, il provoque une mortalité massive, notamment chez le merle noir (Turdus merula), alors que chez l’humain, la majorité des infections passent inaperçues. Cependant, des cas neurologiques graves ont été signalés, en particulier chez les personnes immunodéprimées.
Parvovirose canine : une avancée décisive pour le diagnostic et la prévention
Une étude récente publiée dans Frontiers in Veterinary Science propose une double avancée stratégique pour la prise en charge de la parvovirose chez le chien, une maladie due au parvovirus canin de type 2 (CPV-2) : l’identification de biomarqueurs diagnostiques spécifiques et le développement de nouveaux vaccins vectoriels.
La chasse au loup aux États-Unis a un effet marginal sur la réduction de la prédation du bétail
Publiée dans Science Advances, une recherche menée par l’université du Michigan démontre que la chasse au loup, autorisée dans certains États des Rocheuses, a un effet limité et très variable sur les attaques du bétail.
Table des matières
Une réintroduction qui fait débat
Depuis leur réintroduction dans le parc de Yellowstone et les Rocheuses du Nord au milieu des années 1990, les loups (Canis lupus) sont au cœur d’un débat passionné aux États-Unis. Protégée initialement par l’Endangered Species Act (ESA), l’espèce a vu son statut plusieurs fois modifié, passant d’une protection au niveau fédéral à une gestion décentralisée par les États. Dans l’Idaho et le Montana, la chasse récréative est autorisée depuis le retrait de la protection fédérale. À l’inverse, dans l’Oregon et l’État de Washington, la chasse reste interdite, même si les autorités peuvent ordonner l’abattage ciblé de loups (lethal removals) en cas d’attaques répétées contre le bétail. Cette disparité a offert un terrain d’étude unique pour mesurer l’impact réel de la chasse sur la coexistence entre loups et animaux d’élevage.
Mesurer l’impact réel de la chasse
Une équipe dirigée par Andrew Merz (université du Michigan) a analysé plus de quinze ans de données (2005-2021) afin de répondre à une question centrale : la chasse au loup réduit-elle significativement les pertes de bétail ? Les chercheurs ont utilisé un modèle statistique comparatif, confrontant les États autorisant la chasse (Idaho, Montana) et ceux qui la prohibent (Oregon, Washington). Ils ont également intégré les opérations officielles d’abattage ciblé à la suite d’attaques importantes.
Un effet mesurable mais très faible
L’étude montre qu’en moyenne, chaque loup tué par un chasseur réduit les pertes de bétail de 0,07 tête par an. Ce chiffre équivaut à une réduction d’environ 2 % de la prédation annuelle par loup abattu. Autrement dit, il faut abattre quatorze loups pour épargner une seule tête de bétail. De plus, les auteurs soulignent que cet effet est très variable d’une zone à l’autre. Si certains éleveurs peuvent bénéficier d’une légère réduction des attaques, d’autres continuent de subir des pertes importantes. L’exemple d’un éleveur de l’Idaho, qui a perdu 65 brebis en une seule nuit, illustre la limite d’une approche généralisée de la chasse au loup.
Aucune influence sur l’abattage officiel
Contrairement à ce que certains partisans de la chasse avancent, l’étude montre qu’elle n’a aucun effet significatif sur la fréquence des interventions ordonnées par les agences gouvernementales. En d’autres termes, la chasse récréative n’empêche pas les autorités d’intervenir lorsqu’un groupe de loups attaque de manière répétée le bétail. Les deux dispositifs restent indépendants et n’agissent pas en synergie.
Une question de gestion et de perception
Ces résultats viennent nuancer un débat profondément polarisé. Pour les éleveurs, la chasse représente une mesure de régulation qui pourrait limiter les pertes dans leurs troupeaux. Pour les défenseurs de la faune, elle est au contraire inefficace et contre-productive, risquant de déstabiliser les meutes et d’augmenter les attaques en dispersant les loups. L’étude de Science Advances apporte une réponse claire : la chasse a un effet réel, mais très modeste, limité et inégalitaire. Elle ne constitue pas une stratégie efficace de gestion globale, mais un outil marginal, aux bénéfices faibles par rapport aux attentes sociétales.
Vers une gestion intégrée du loup et du bétail
Les auteurs concluent que l’avenir de la gestion du loup doit s’appuyer sur une approche plus fine et intégrée. La simple chasse récréative ne suffit pas à résoudre les conflits entre prédateurs et éleveurs. D’autres stratégies, souvent non létales, pourraient offrir de meilleurs résultats :
- la protection renforcée des troupeaux (chiens de protection, clôtures électrifiées) ;
- une surveillance accrue lors des périodes de mise bas ;
- des indemnisations mieux ciblées pour compenser les pertes ;
- des politiques de coexistence reposant sur la concertation entre éleveurs, scientifiques et gestionnaires de la faune.
Un débat loin d’être clos
En démontrant que la chasse au loup réduit les pertes de bétail de seulement 2 % par loup abattu, cette étude apporte un argument étayé dans un débat dominé par les postures idéologiques. Loin de clore la controverse, elle souligne au contraire la nécessité de fonder les politiques de gestion sur des preuves scientifiques, et non sur des perceptions ou des pressions politiques.
Comme le rappellent les auteurs, la coexistence entre l’humain, le bétail et les carnivores sauvages ne peut reposer que sur une seule mesure, qui exige une combinaison de stratégies adaptées aux réalités locales, intégrant l’écologie, l’économie et l’acceptabilité sociale.
Peste porcine africaine (PPA) : expansion à 51 pays, flambée estivale et urgence sanitaire mondiale
La PPA continue de se propager à l’échelle mondiale. Entre janvier 2024 et mai 2025, 14 918 foyers ont été signalés dans 51 pays et territoires, avec 386 089 cas identifiés et 605 225 pertes animales déclarées. Cette situation résulte d’un cumul d’épisodes qui ont touché la faune sauvage et les élevages porcins, soulignant une crise persistante. Certaines zones nouvellement touchées incluent le Monténégro, l’Albanie, le Sri Lanka, le Bhoutan, la Côte d’Ivoire, l’Allemagne, la Pologne, et les Philippines qui ont enregistré 1 269 foyers parmi les porcs domestiques.
Fièvre catarrhale ovine : le virus pourrait aussi menacer les chiens
Longtemps considérée comme une maladie n’affectant que les ruminants, la fièvre catarrhale ovine (FCO) pourrait bien élargir son spectre. C’est ce que suggère une revue scientifique publiée dans Veterinary Sciences, qui alerte sur des cas documentés chez les carnivores, notamment les chiens. Un changement de paradigme qui appelle à revoir les outils de surveillance et les pratiques vétérinaires.
Grippe aviaire : les changements de paysages en Asie orientale favorisent l’émergence de nouveaux virus
Une étude montre que la transformation des zones humides et agricoles accélère la diversification des virus influenza aviaires. Les changements rapides des paysages le long de la voie de migration Asie de l’Est-Australasie (EAAF) accroissent fortement les risques d’émergence de nouveaux sous-types de grippe aviaire. C’est la conclusion d’une étude publiée mi-août dans la revue Proceedings of the National Academy of Sciences (PNAS).
Table des matières
Un couloir migratoire sous pression écologique
La voie de migration Asie de l’Est-Australasie est l’une des plus importantes au monde. Chaque année, des millions d’oiseaux d’eau la parcourent entre la Sibérie, la Mongolie et leurs zones d’hivernage en Chine et en Asie du Sud-Est. Ces oiseaux jouent un rôle central dans la dynamique des virus influenza aviaires. Or, entre 2000 et 2015, cette région a subi de profonds bouleversements environnementaux.
La disparition progressive de zones humides dans l’est de la Chine, au Japon et en Corée a réduit l’espace disponible pour les oiseaux migrateurs. Dans le même temps, les surfaces en rizières ont augmenté dans le nord de la Chine, attirant davantage de migrateurs. L’augmentation locale des zones inondées en Russie et dans le nord-est de la Chine, liée à l’abandon de terres agricoles et au changement climatique, a par ailleurs modifié la répartition spatiale des espèces.
Ces mutations entraînent une redistribution des populations d’oiseaux. Certaines espèces se retrouvent concentrées dans des habitats restreints, la densité favorisant la transmission virale. D’autres colonisent des zones agricoles partagées avec les volailles domestiques, ce qui accroît les risques de contacts et donc de transmission croisée.
Le rôle clé du réassortiment génétique
L’un des mécanismes les plus préoccupants dans l’évolution des virus influenza est le réassortiment génétique. Lorsqu’un hôte, oiseau sauvage ou volaille domestique, est infecté simultanément par deux souches différentes, ces virus peuvent échanger des segments de gènes et créer un nouveau sous-type. Ce processus ne garantit pas automatiquement l’apparition d’une souche hautement pathogène, mais il augmente considérablement la diversité virale et prépare le terrain pour l’émergence de variants plus dangereux.
L’étude souligne que les volailles domestiques constituent un véritable “incubateur” de virus. En effet, si les oiseaux sauvages sont porteurs de nombreux virus faiblement pathogènes (LPAI), leur transmission aux élevages aviaires favorise les co-infections et multiplie les opportunités de réassortiment. Dans un contexte où les surfaces agricoles partagées (notamment les rizières) augmentent, les conditions sont réunies pour accélérer la diversification des souches.
Une modélisation inédite pour mesurer l’impact des paysages
Afin de quantifier ces risques, les chercheurs ont développé un modèle fondé sur les individus (individual-based model, IBM). Ce modèle s’appuie sur des données empiriques variées : suivi satellitaire de 79 oies rieuses (Anser albifrons) équipées de colliers GPS entre 2014 et 2016, données naturalistes issues de la plateforme eBird, télédétection pour cartographier zones humides, rizières et surfaces en eau, et informations sur la densité de volailles domestiques. Ce modèle a permis de simuler les migrations et d’estimer la dynamique des transmissions entre oiseaux sauvages et volailles. En comparant les années 2000 et 2015, les chercheurs ont mesuré comment l’évolution des paysages influençait la circulation virale. Pour aller plus loin, ils ont utilisé des méthodes statistiques avancées, comme la modélisation d’équations structurelles (piecewiseSEM), afin d’identifier les variables environnementales ayant le plus d’impact sur la distribution des oiseaux et sur l’incidence des réassortiments.
Des résultats alarmants : un risque multiplié par seize
Les résultats du modèle sont édifiants. Entre 2000 et 2015, le taux de réassortiment viral a augmenté de 1 593 %, soit une multiplication par seize. Les zones à risque, initialement concentrées dans quelques foyers, se sont élargies pour englober le sud-est de la Chine, le bassin du fleuve Jaune et le nord-est de la Chine. Les nouvelles surfaces rizicoles dans le nord attirent des populations importantes d’oiseaux migrateurs, augmentant mécaniquement la probabilité de contacts avec les volailles.
Ces résultats correspondent aux observations historiques. Aucun événement majeur de réassortiment n’avait été signalé avant 1995, mais entre 1996 et 2015, leur fréquence a fortement augmenté en Asie de l’Est, en parallèle des transformations paysagères.
Des implications directes pour l’agriculture et la santé publique
Depuis son émergence en 1996, le virus H5 hautement pathogène n’a cessé de se diversifier. Les sous-types comme H5N8 et H5N1 clade 2.3.4.4b ont franchi de nouvelles barrières d’espèces, touchant oiseaux sauvages, volailles, mammifères marins et bovins laitiers. Ces franchissements montrent que l’évolution des virus influenza n’est pas indépendante des activités humaines : elle est au contraire amplifiée par l’agriculture, l’urbanisation et la gestion des paysages.
Pour les éleveurs, la proximité des exploitations avicoles avec les zones humides et rizicoles constitue un risque majeur. Pour les autorités de santé, la perspective de nouvelles souches transmissibles à l’humain impose de renforcer la surveillance virologique dans les zones à risque. Pour les écologues, la gestion des zones humides n’est plus seulement un enjeu de biodiversité, mais aussi une composante de la sécurité sanitaire mondiale.
Vers une approche “One Health” intégrée
Les auteurs insistent sur la nécessité d’adopter une approche véritablement interdisciplinaire, dans l’esprit du concept “One Health”. Comprendre et prévenir les émergences virales suppose de combiner l’écologie des migrations, la biologie évolutive des virus, la modélisation informatique et les politiques agricoles. La dynamique des virus ne dépend pas uniquement des mutations aléatoires, mais aussi des choix d’aménagement du territoire et des transformations climatiques.
Comme le rappelle l’un des auteurs, « les changements du paysage ne sont pas seulement des transformations visuelles, ils redessinent la carte mondiale des risques infectieux ».
Climat, agriculture et virus : un avenir à haut risque
L’étude démontre de manière claire que la modification des paysages agricoles et naturels joue un rôle central dans l’évolution des virus influenza aviaires. Alors que le changement climatique, l’intensification agricole et la perte de biodiversité s’accélèrent, le risque d’apparition de nouvelles souches préoccupantes est plus élevé que jamais. Le bassin du Yangtsé, le fleuve Jaune ou les grandes plaines rizicoles de Chine ne sont pas seulement des territoires stratégiques pour l’agriculture : ils apparaissent désormais comme des foyers potentiels de la prochaine grande mutation virale.
Un cas rare de peste transmis par un chat alerte les autorités sanitaires américaines
Un homme de 73 ans a contracté la peste après avoir soigné son chat malade. Ce cas interpelle par son caractère atypique : la contamination s’est produite au cœur de l’hiver, une période classiquement considérée comme “hors saison” pour cette maladie endémique de l’Ouest américain.
Grippe aviaire H5N1 : un tropisme viral élargi, un lait contaminé et un risque zoonotique accru
Le virus H5N1, longtemps associé aux oiseaux, a franchi une nouvelle étape dans son évolution. En infectant les bovins laitiers et en se répliquant dans la glande mammaire, il modifie son tropisme viral et révèle un nouveau mode de transmission via le lait cru. Les scientifiques alertent sur une dynamique inédite et potentiellement dangereuse.
Royaume-Uni : le virus du Nil occidental détecté pour la première fois chez des moustiques indigènes
Une étude rétrospective menée au Royaume-Uni révèle la première détection du virus du Nil occidental (ou virus West Nile) chez des moustiques locaux en 2023. Bien que le risque sanitaire reste faible, ce signal virologique renforce les appels à une surveillance accrue dans un contexte de changement climatique.
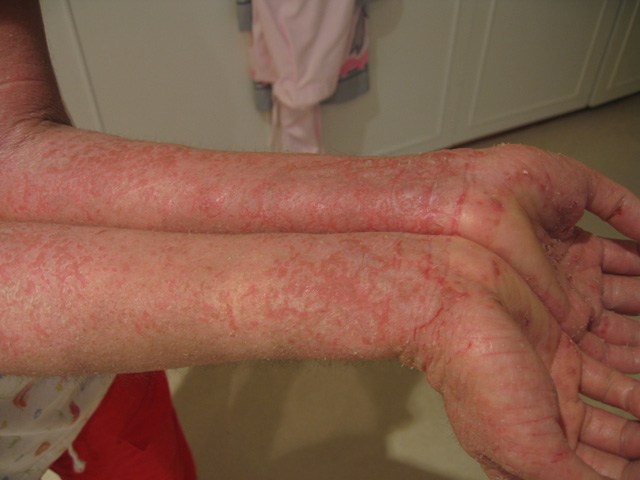
Exposer les bébés aux chiens : une piste génétique contre l’eczéma infantile
Une étude montre un lien inédit entre la présence d’un chien à la maison durant la petite enfance et une réduction du risque d’eczéma chez les enfants porteurs d’une prédisposition génétique. Cette étude apporte pour la première fois une explication au niveau moléculaire d’un phénomène longtemps observé… mais jamais élucidé.
Grippe aviaire H5N1 : 70 cas humains aux États-Unis, dont un décès, liés aux bovins laitiers
Le virus H5N1 ne se limite plus aux oiseaux. Aux États-Unis, des travailleurs agricoles ont été infectés après un contact direct avec des vaches laitières contaminées. Une nouvelle étude met en lumière cette évolution préoccupante.
Chats et Covid-19 : une exposition plus fréquente que prévue
Une étude menée entre novembre 2021 et mars 2022 dans la région de Lisbonne (Portugal) révèle que près d’un tiers des chats vivant dans des foyers où au moins une personne a été testée positive au Sars-CoV-2 ont développé des anticorps contre le coronavirus. Ces résultats soulignent l’importance d’intégrer les animaux de compagnie dans les stratégies de surveillance épidémiologique.